비산 (화학)
보이기
| |

| |
| 이름 | |
|---|---|
| IUPAC 이름
Arsenic acid, arsoric acid
| |
| 별칭
Arsenic acid
Orthoarsenic acid Desiccant L-10 Zotox | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.029.001 |
| EC 번호 |
|
| KEGG | |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
| UN 번호 | 1553, 1554 |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| H 3AsO 4 | |
| 몰 질량 | 141.94 g/mol |
| 겉보기 | White translucent crystals, hygroscopic. |
| 밀도 | 2.5 g/cm3 |
| 녹는점 | 35.5 °C (95.9 °F; 308.6 K) |
| 끓는점 | 120 °C (248 °F; 393 K) decomposes |
| 16.7 g/100 mL | |
| 용해도 | soluble in alcohol |
| 증기 압력 | 55 hPa (50 °C) |
| 산성도 (pKa) | 2.19, 6.94, 11.5 |
| 짝염기 | Arsenate |
| 구조 | |
| Tetrahedral | |
| 위험 | |
| 주요 위험 | Extremely toxic, carcinogenic, corrosive |
| GHS 그림문자 |     
|
| 신호어 | 위험 |
| H301, H312, H314, H318, H331, H350, H361, H400, H410 | |
| P201, P202, P260, P261, P264, P270, P271, P273, P280, P281, P301+310, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P308+313, P310, P311, P312, P321, P322, P330, P363, P391 | |
| NFPA 704 (파이어 다이아몬드) | |
| 인화점 | Non-flammable |
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |
LD50 (median dose)
|
48 mg/kg (rat, oral)
6 mg/kg (rabbit, oral) |
| 관련 화합물 | |
다른 음이온
|
Phosphoric acid |
다른 양이온
|
Sodium arsenate |
관련 화합물
|
Arsenous acid Arsenic pentoxide |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
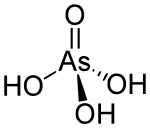
비산(Arsenic acid)은 화학식 H
3AsO
4을 갖는 화합물이다. 더 기술적으로 쓰면 AsO(OH)3로 명기하며, 이 무색의 산 물질은 인산과 비슷한 비소이다. 비산염과 인산염은 매우 비슷한 행동을 보인다. 비산은 분리된 상태가 아닌, 이온화된 용액에서만 발견된다. 결정 샘플은 100°C에서 물방울과 함께 건조된다.[1]
준비
[편집]- As2O3 + 2 HNO3 + 2 H2O → 2 H3AsO4 + N2O3
기타 방식
[편집]- 2 As + 3 H2O + 5 O3 → 2 H3AsO4 + 5 O2
비산에 3 당량의 수산화 나트륨을 첨가하면, 비산나트륨(NaAsO4)를 형성한다.
H3AsO4 + 3 NaOH ---> Na3AsO4
각주
[편집]- ↑ Holleman, A. F.; Wiberg, E. (2001). 《Inorganic Chemistry》. San Diego: Academic Press. ISBN 0-12-352651-5.

